Notre expertise pour une entrée réussie sur le marché européen
Les dispositifs médicaux de diagnostic in vitro (DIV) sont utilisés pour analyser des échantillons du corps humain à des fins médicales. Le terme couvre des produits aussi divers que les réactifs, les matériaux d'étalonnage, les matériaux de contrôle, les kits, les instruments, les systèmes et les logiciels. Les résultats des tests pour lesquels les DIV sont utilisés influencent les décisions médicales qui ont un impact direct sur le santé des patients ; la sécurité et la fiabilité de ces dispositifs médicaux revêtent donc une importance particulière.
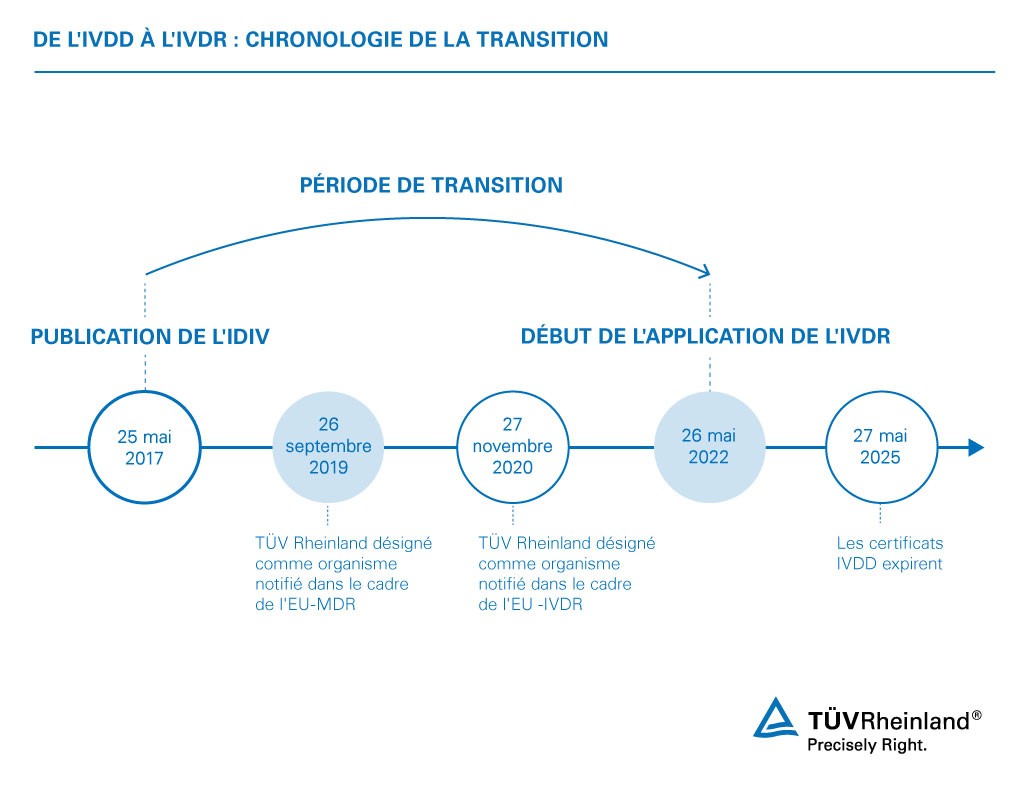
Depuis 1998, les dispositifs médicaux de diagnostic in vitro sont réglementés par la directive 98/79/CE. Le 25 mai 2017, le nouveau règlement européen sur les dispositifs médicaux de diagnostic in vitro (DMDIV) 2017/746 est entré en vigueur, imposant des exigences plus étendues aux DMDIV et à leurs fabricants. Après une période de transition de cinq ans, les produits doivent répondre aux exigences de l'IVDR pour recevoir le marquage CE et être autorisés à entrer sur le marché européen. (Une période de transition plus longue s'applique à quelques exceptions.) Il convient de noter que le marquage CE constitue un avantage concurrentiel sur de nombreux marchés dans le monde.
En tant qu'un des deux organismes notifiés dans le monde, nous offrons des services tout au long de votre transition vers IVDR. En tant que fournisseur unique disposant d'une gamme complète de services d'essais médicaux et de certification, nous pouvons vous offrir un service personnalisé adapté à vos produits et à vos besoins spécifiques.

Mise à jour importante sur le règlement de l'UE 2024/1860 : Périodes de transition prolongées et nouvelles exigences pour les DMDIV
Le 9 juillet, le règlement (UE) 2024/1860 a été publié au Journal officiel de l'Union européenne et est entré en vigueur. Ce règlement modifie les règlements (UE) 2017/745 (MDR) et (UE) 2017/746 (IVDR) et couvre les trois sujets suivants :
• Le déploiement progressif d'Eudamed au fur et à mesure de la disponibilité des différents modules
• L'obligation pour les fabricants d'informer le public en cas d'interruption ou de cessation de l'approvisionnement
• Des dispositions transitoires pour certains dispositifs médicaux de diagnostic in vitro (DMDIV).
L'un des changements les plus importants résultant du nouveau règlement est la prolongation de la période de transition de l'IVDR pour les dispositifs déjà mis sur le marché dans le cadre de la directive 98/79/CE (IVDD), dits « legacy devices ». Les dispositifs qui ont été retirés du champ d'application de la certification IVDD ou qui ont subi une modification importante ne peuvent pas bénéficier des nouvelles dispositions transitoires, à moins que des conditions spécifiques ne soient remplies.
Les nouvelles dispositions transitoires garantissent la continuité de l'approvisionnement des DMDIV sur le marché, tout en donnant aux fabricants et aux organismes notifiés le temps d'approuver les « legacy devices » dans le cadre de l'IVDR. Les fabricants de « legacy devices » doivent avoir signé un accord avec leur organisme notifié pour une évaluation de la conformité et avoir déposé une demande de certification au titre de l'IVDR pour bénéficier des périodes de transition prolongées. Ils doivent également avoir mis en œuvre les exigences du système de gestion de la qualité dans le cadre de l'IVDR avant le 26 mai 2025.
En tant que l'un des premiers organismes notifiés à recevoir des notifications pour les DIV dans le cadre de l'IVDR, TÜV Rheinland accueille favorablement les nouveaux délais et soutiendra les clients au cours du processus de transition prolongé. Il est important que les fabricants continuent de travailler à la transition pour éviter que les organismes notifiés ne soient surchargés d'examens et de certifications dans les nouveaux délais. TÜV Rheinland préparera toutes les procédures et tous les modèles nécessaires pour assurer une transition en douceur et vous tiendra au courant.
Tous les services de l'IVDR
Avec 40 ans d'expérience en tant que fournisseur de services de tests pour la sécurité et la qualité des dispositifs médicaux de diagnostic in vitro (DIV), nous sommes un partenaire compétent pour la transition vers l'IVDR. En outre, nous aidons les fabricants de DIV et de dispositifs médicaux à accéder aux marchés européens et internationaux.
Avez-vous des questions sur l'IVDR ?
Forts de notre expérience en tant qu'organisme notifié pour la certification des dispositifs médicaux de diagnostic in vitro, nous vous aidons à passer de la directive sur les dispositifs médicaux de diagnostic in vitro au règlement sur les dispositifs médicaux de diagnostic in vitro, en respectant les délais et en nous occupant de nombreux autres aspects importants pour l'entrée de vos produits sur le marché européen.
Nous avons résumé ici les questions et les réponses les plus importantes.
Plus d'informations
Nouveau règlement pour les dispositifs médicaux de diagnostic in vitro :



/tuv-rheinland-de19_p05_ivd09-lp_core_4_3.jpg)

/tuv-rheinland-in-vitro-diagnostic-devices-(ivd)-sk-297595064_core_4_3.jpg)