La nostra esperienza per un ingresso vincente nel mercato europeo
I dispositivi medici diagnostici in vitro (IVD) sono utilizzati per analizzare campioni del corpo umano per scopi medici. La dicitura raggruppa prodotti diversi quali reagenti, materiali di calibrazione, materiali di controllo, kit, strumenti, sistemi e software. I risultati dei test in cui vengono utilizzati gli IVD influenzano le decisioni mediche che riguardano direttamente il benessere del paziente, quindi la sicurezza e l'affidabilità di questi dispositivi medici è di particolare importanza.
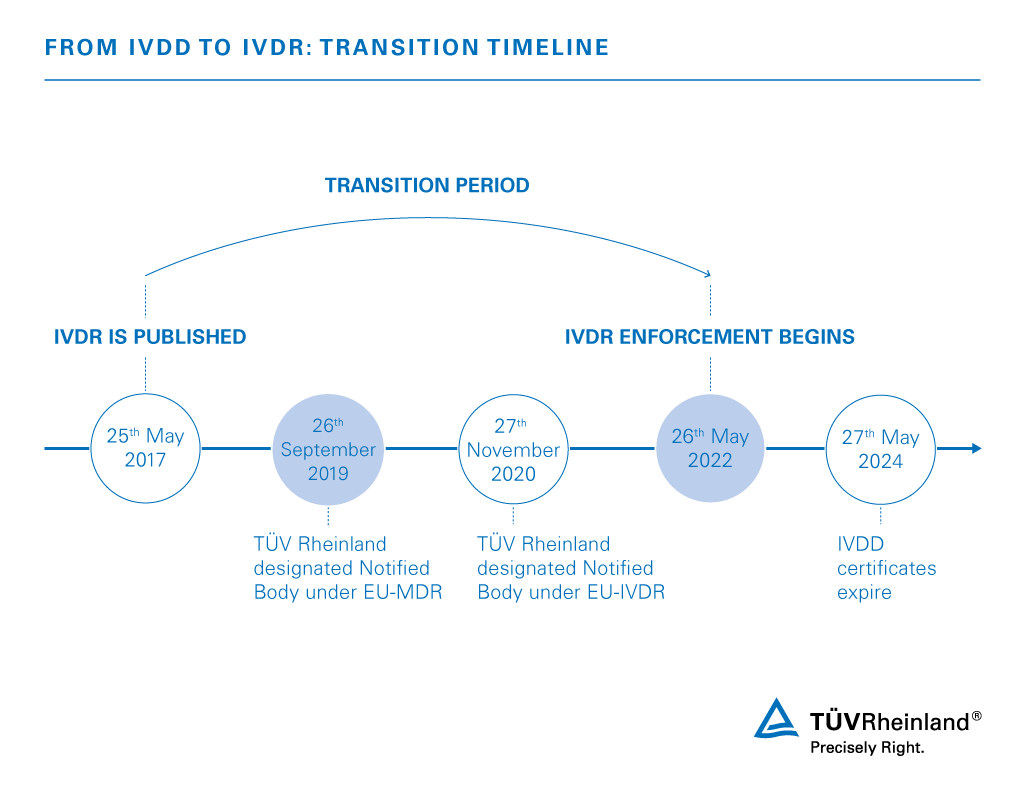
Dal 1998, i dispositivi medici diagnostici in vitro sono regolati dalla direttiva 98/79/CE. Il 25 maggio 2017 è entrato in vigore il nuovo regolamento UE sui dispositivi medici diagnostici in vitro (IVDR) 2017/746, che pone maggiori obblighi sugli IVD per i loro Fabbricanti. Dopo un periodo di transizione di cinque anni, i prodotti devono soddisfare i requisiti dell'IVDR per ottenere la marcatura CE e poter entrare nel mercato europeo (in alcuni casi è previsto un periodo di transizione più lungo). È importante sottolineare che la marcatura CE fornisce un vantaggio competitivo in molti mercati in tutto il mondo.
In qualità di uno degli attuali cinque Organismi Notificati in tutto il mondo (stato al 19 novembre 2020), ti offriamo servizi in grado di coprire tutta la transizione alla nuova IVDR. Come ente unico forniamo una gamma completa di test medici e servizi di certificazione, offrendoti un servizio specifico per i tuoi prodotti e adeguato alle tue esigenze.
Transition Period for the EU Regulation IVDR 2017/746 | TÜV Rheinland
Tutti i servizi IVDR
Con 40 anni di esperienza come fornitore di servizi di test per la sicurezza e la qualità dei dispositivi medici diagnostici in vitro (IVD), siamo un partner competente per la transizione all'IVDR. Inoltre, supportiamo i fabbricanti di IVD e dispositivi medici con servizi di accesso al mercato europeo e internazionale.
Hai delle domande sulla IVDR?
Con la nostra esperienza come Organismo Notificato per la certificazione di dispositivi medici diagnostici in vitro, ti supportiamo durante la transizione dalla Direttiva IVD all'IVDR in rispetto alle scadenze e ad altri adempimenti rilevanti per l’accesso dei tuoi prodotti nel mercato europeo.
Panoramica delle domande e delle risposte di maggior interesse.
Maggiori informazioni
Nuovo regolamento sui dispositivi medici diagnostici in vitro:



/tuv-rheinland-de19_p05_ivd09-lp_core_4_3.jpg)
/tuv-rheinland-in-vitro-diagnostic-devices-(ivd)-sk-297595064_core_4_3.jpg)
