Affidati alla nostra esperienza per avere successo nel mercato europeo
I fabbricanti e i distributori di dispositivi medici sono generalmente molto attenti alle questioni relative alla certificazione e all'approvazione di mercato dei loro prodotti. Dal 1993, questi aspetti sono regolati dai requisiti della MDD. Nel 2017, la Commissione UE ha adottato il Regolamento Europeo sui Dispositivi Medici 2017/745 con un periodo di transizione iniziale di tre anni, che è stato poi esteso a quattro anni, fissando la data di applicazione al 26 maggio 2021.
Tutti i dispositivi medici che vengono immessi sul mercato nell'UE dopo la data di applicazione dovranno essere conformi ai requisiti della MDR. I prodotti che sono già certificati potranno ancora venire commercializzati, purché vengano rispettate alcune disposizioni transitorie, fino alla fine della validità dei rispettivi certificati, ma non oltre il 26 maggio 2024.
I nostri esperti di TÜV Rheinland, presetni in tutto il mondo, anche nel tuo Paese. In qualità di Organismo Notificato designato per eseguire valutazioni di conformità ai sensi della MDR, controlliamo il tuo sistema di gestione della qualità ed esaminiamo la tua documentazione tecnica.
Scadenze e disposizioni transitorie
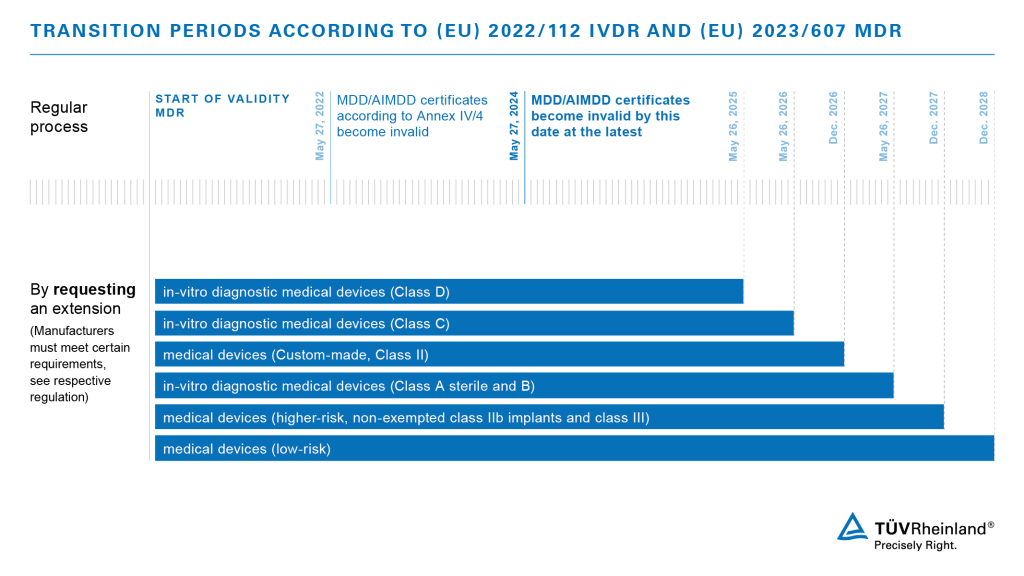
Questo periodo di transizione si applica solo se
- i dispositivi medici continuano a soddisfare i requisiti delle direttive e se la sorveglianza da parte dell'attuale Organismo Notificato è ancora garantita,
- sono soddisfatti anche i requisiti aggiuntivi della MDR, compresi i requisiti per la registrazione degli operatori di mercato e dei prodotti, per la sorveglianza post-commercializzazione dei prodotti e per la segnalazione di incidenti,
- non sono state apportate modifiche significative alla progettazione o all'uso previsto dei prodotti.
Tutti i servizi MDR
Siamo un Organismo Notificato con una grande esperienza e competenza nella partecipazione alle procedure di valutazione della conformità. TÜV Rheinland è il tuo partner di fiducia per la transizione dalle direttive 93/42/CEE (MDD) e 90/385/CEE (AIMDD) ai nuovi requisiti MDR, così come per la ricertificazione dei tuoi dispositivi medici secondo la nuova MDR.
Hai delle domande sulla MDR?
Il nuovo Regolamento sui Dispositivi Medici 2017/745 pone nuovi requisiti ai fabbricanti di dispositivi medici. Con la nostra esperienza come Organismo Notificato per i dispositivi medici, siamo il partner ideale per affiancartidurante la transizione al nuovo regolamento.
Panoramica delle domande e delle risposte di maggior interesse.
Nuovi regolamenti per i dispositivi medici:


