欧州市場参入を成功させるための専門知識
体外診断用医療機器(IVD)は、医療目的で人体の検体を分析するために使用されます。この用語は、試薬、校正物質、管理物質、キット、機器、システム、ソフトウェアなど多様な製品を対象にしています。体外診断用医療機器が使用される検査結果は、患者の健康に直接影響する医療上の意思決定に影響するため、これらの医療機器の安全性と信頼性は特に重要です。
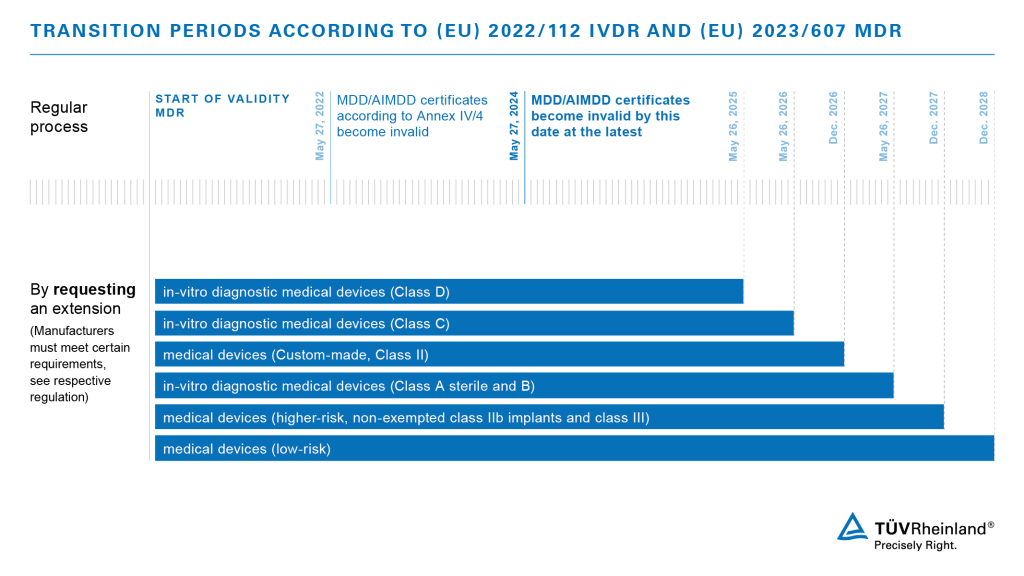
1998年以来、体外診断用医療機器は指令98/79/ECによって規制されてきました。2017年5月25日、体外診断用医療機器に関する新たなEU規則(IVDR)2017/746が施行され、体外診断用医療機器とその製造業者に対してより広範な要求事項が課されました。5年間の移行期間を経て、CEマークを取得し欧州市場への参入を許可されるためには、製品はIVDRの要求事項を満たさなければならなりません(移行期間が5年以上の例外もあります)。CEマーキングは、世界の多くの市場で、競争上の優位性をもたらすことは、特筆すべきでしょう。
現在、世界に5つあるノーティファイド・ボディ(Notified Body)の1つ(2020年11月19日付)であるテュフ ラインランドは、新IVDRへの移行期間を通じてサービスを提供します。包括的な医療試験および認証サービスを提供するワンストップのプロバイダーとして、お客様の特定の製品やニーズに合わせてカスタマイズしたサービスを提供することが可能です。
IVDRに関連するサービスについてもっとお知りになりたい場合は、テュフ ラインランドの専門家にご連絡ください。
IVDR欧州体外診断用医療機器規則に関するサービス
体外診断用医療機器(IVD)の安全性と品質に関する試験サービスプロバイダーとして40年の経験を持つテュフ ラインランドは、IVDRへの移行のための有能なパートナーです。さらに、欧州および国際市場へのマーケットアクセス・サービスにより、体外診断用医薬品および医療機器の製造業者をサポートします。
IVDRについてご質問がある場合
体外診断用医療機器の認証に関するノーティファイドボディとしての経験を生かし、IVD指令からIVDRへの移行期間中、期限遵守や、貴社の製品が欧州市場に参入するために必要なその他さまざまな面で貴社をサポートします。
最も重要な質問と回答
関連情報
体外診断用医療機器の新規則:



/tuv-rheinland-de19_p05_ivd09-lp_core_4_3.jpg)

/tuv-rheinland-in-vitro-diagnostic-devices-(ivd)-sk-297595064_core_4_3.jpg)
