我们拥有丰富的专业知识,助您成功进军欧洲市场
体外诊断医疗器械(IVD)是用于分析人体样本的医疗器械。这一类型的医疗器械涵盖各种产品,包括试剂、校准品、对照品 、试剂盒、仪器、系统和软件。IVD的检查结果会用于制定治疗方案,这将直接对患者的健康福祉造成影响,因此,这些医疗器械的安全性和可靠性尤为重要。
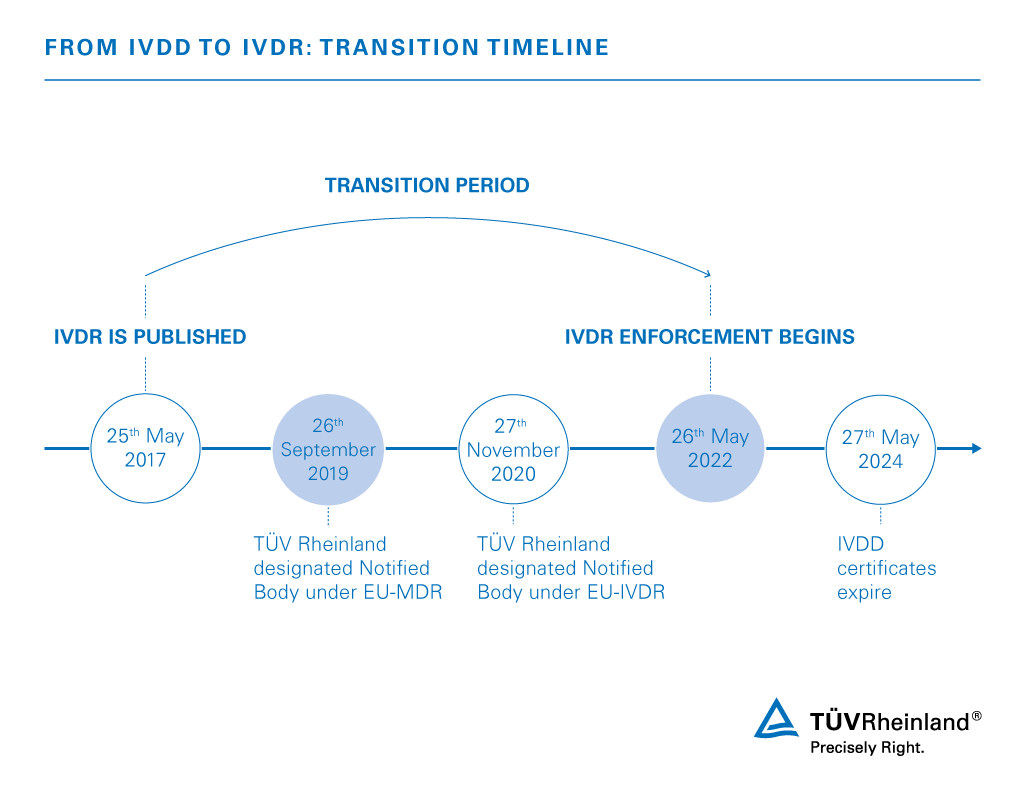
1998年颁发了关于体外诊断医疗器械的98/79/EC指令。2017年5月25日,新的欧盟体外诊断医疗器械法规(IVDR)2017/746正式生效,对IVD及其制造商提出了更广泛的要求。新的法规规定经过五年的过渡期后,产品必须满足IVDR的要求,才能获得CE标志,并进入欧洲市场。(少数例外情况,可获得较长的过渡期)值得注意的是,CE标志在全球许多市场都具有竞争优势。
我们是目前(2020年11月19日)全球五大认证机构之一,可为您的过渡期全程保驾护航,助您满足新的IVDR法规要求。作为综合医疗检测和认证服务的单一来源供应商,我们可以根据您的特定产品和需求为您提供定制服务。
IVDR相关的所有服务
在体外诊断医疗器械(IVD)安全性和质量的检测服务领域,我们拥有40年的经验,是您向IVDR过渡的得力助手。此外,我们还为IVD和医疗器械制造商提供进入欧洲和国际市场的市场准入服务。


/tuv-rheinland-de19_p05_ivd09-lp_core_4_3.jpg)

/tuv-rheinland-in-vitro-diagnostic-devices-(ivd)-sk-297595064_core_4_3.jpg)
