我们拥有丰富的经验,能够助您成功进军欧洲市场
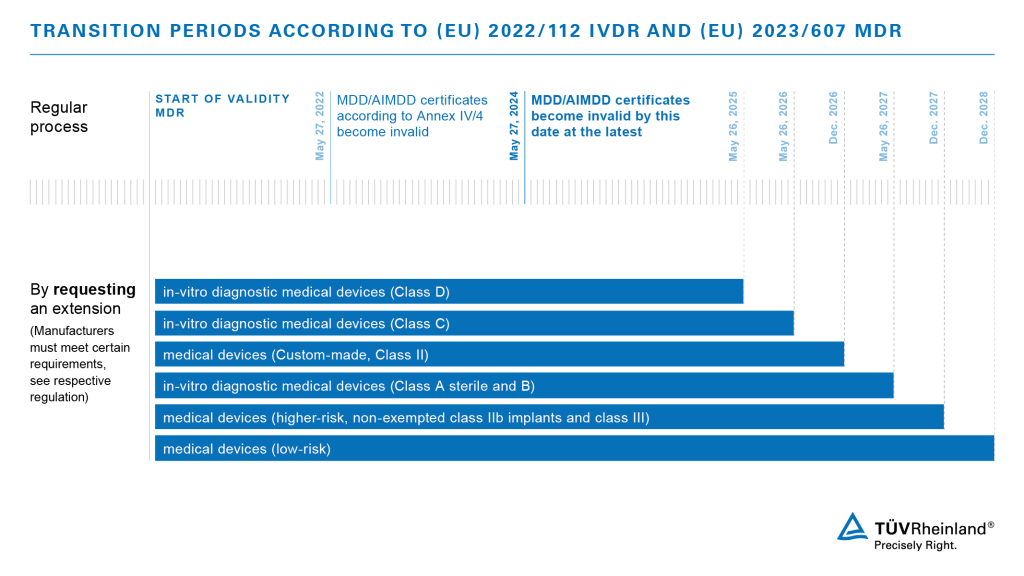
在产品认证和市场认可上,医疗器械的制造商和分销商一直是首当其冲的。1993年以来,医疗器械上市前必须符合MDD的规定。2017年,欧盟委员会通过了《欧洲医疗器械法规2017/745》(MDR 2017/745),法规过渡期初定为三年,后来延长为四年,即正式实施的日期为2021年5月26日。
所有在正式实施日后投放欧盟市场的医疗器械必须符合MDR的规定。已通过认证的产品可在满足某些过渡期规定的前提下,在其证书有效期结束前投放市场,但投放日期不得迟于2024年5月26日。
德国莱茵TÜV集团的专家已经对MDR的各项变化进行了深入研究,他们遍布世界各地,总有一个在您身边。我们是MDR符合性评估认证机构,能够对贵司的质量管理体系进行审核,对技术文档进行审查等。
关于MDR的全部服务
我们是一家符合性评估认证机构,拥有丰富的经验和专业技术。当贵司需要从93/42/EEC(MDD)和90/385/EEC(AIMDD)指令过渡到MDR新规时,德国莱茵TÜV集团LGA产品有限公司 将是您值得信赖的合作伙伴。
关于MDR,您还有其他问题吗?
新的《欧盟医疗器械法规 2017/745》对医疗器械制造商提出了新的要求。我们作为认证机构,在医疗器械相关服务方面经验丰富,能够协助贵司向新规过渡,是贵司理想的合作伙伴。